Compte tenu de la sensibilité des nouveau-nés aux agents pathogènes, ils sont généralement traités avec des antibiotiques s’ils ont une infection. Plus de la moitié des nouveau-nés sont traités par antibiotiques dans le premier mois suivant la naissance. Les antibiotiques, bien qu’utiles pour guérir les maladies infectieuses, apportent certains changements défavorables aux corps hôtes. Certains de ces changements sont attribués aux impacts d’antibiotiques sur les microorganismes du tractus gastro-intestinal, puisque ces microbiotes intestinaux sont fortement associés à la santé. Des études récentes ont révélé que le microbiote intestinal est également étroitement associé à la croissance des nourrissons. Et il été confirmé que le microbiote intestinal affectait la croissance des nouveau-nés en contrôlant la sécrétion et l’activité des hormones de croissance et du facteur de croissance analogue à l’insuline (IGF).
L’utilisation à long terme d’Antibiotiques, en particulier de ceux oraux, peut détruire l’équilibre du microbiote intestinal et avoir un impact négatif sur le développement des nouveau-nés. Le terme « microbiote » désigne l’ensemble des micro-organismes (bactéries, virus et champignons) vivant à la surface des muqueuses. Entre 800 et 1000 espèces de bactéries constituent le microbiote intestinal (soit 3 à 4 x1013 bactéries). L’ensemble de ce microbe naturel entretient une relation complexe avec leur hôte. Le tout est géré selon un équilibre y participent de nombreuses fonctions biologiques telles que la digestion, le développement du système immunitaire et le développement des bactéries intestinales.
Dysbiose intestinale, un facteur de risque identifié lorsque cet équilibre est altéré. Il devient de plus en plus clair que le processus d’approvisionnement avec certaines souches microbiennes est bénéfique pour notre santé. On parle de VSL qui est un mélange probiotique commercial contenant huit souches bactériennes pour remplacer les souches naturelles.
La dysbiose intestinale, et les perturbations qu’elle entraîne, ont de multiples conséquences en santé humaine, aussi bien à court qu’à long terme. La prise d’antibiotique est un phénomène de grande ampleur : on estime en effet que dans les pays développés, 50 % des enfants ont reçu un traitement antibiotique avant l’âge de 1 an. Si on connait depuis longtemps le risque de diarrhées post-antibiotique (10 à 30 % des cas en pédiatrie), on découvre depuis quelques années à travers de larges études épidémiologiques le lien entre la dysbiose intestinal et des pathologies chroniques impliquant des mécanismes inflammatoires, allergiques ou auto-immuns. Citons ainsi l’obésité, le syndrome de l’intestin irritable, ou encore l’asthme (d’après la communication « Short and long-term impacts of antibiotic use » d’Alexis Mosca, hôpital Robert Debré, Paris).
Prévenir la dysbiose intestinale

Il a été rapporté que ces souches bactériennes peuvent atténuer les réponses inflammatoires dans les maladies inflammatoires de l’intestin. Après une dysbiose du microbiote intestinal induite par le traitement Antibiotique, la neurogenèse de l’hippocampe et la fonction de la mémoire gastrique diminuent, mais une greffe de VSL peut inverser la performance altérée dans l’hippocampe. Dans cet article scientifique, nous parleront également des résultats cohérents montrant qu’une transplantation du mélange probiotique VSL est bénéfique pour inverser l’altération du développement cornéen chez les expérimentés traités à l’Antibiotique et restaurer la proportion de CCR2 -macrophages (macrophages négatifs aux récepteurs de chimiokine C – C de type 2 (CCR2 – )). Ainsi, les études confirment le potentiel des probiotiques à être une stratégie thérapeutique pour guérir un déficit du développement cornéen induit par la dysbiose du microbiote intestinal chez les bébés et les humains de façon générale. Les résultats suggèrent que le traitement antibiotique provoque une dysbiose du microbiote intestinal et altère le développement cornéen, notamment en modifiant la morphogenèse cornéenne et la formation des vaisseaux sanguins limbiques et les nerfs cornéens. Ces déficiences du développement cornéen peuvent principalement être inversées par la reconstitution du microbiote intestinal par transplantation fécale et par le traitement probiotique. En outre, CCR2 – macrophages ont été confirmés à participer au développement de la cornée, et la distribution de ces cellules est régulée par microbiote intestinal. Bien que le déficit de développement cornéen induit par le traitement antibiotique soit un processus complexe, nos résultats mettent en lumière les rôles importants du microbiote intestinal homéostatique dans le développement cornéen et soulignent l’importance du CCR2 – macrophages dans ce processus de développement. De plus, il a été confirmé que les macrophages négatifs aux récepteurs de chimiokine C – C de type 2 (CCR2 – ) participent au développement de la cornée, et leur distribution dans la cornée a été régulée par le microbiote intestinal. Nous supposons que le CCR2 – macrophages sont des médiateurs importants dans le microbiote intestinal affectant le développement cornéen chez les nouveaux nés. De plus, les probiotiques se sont avérés avoir l’effet potentiel de restaurer le développement cornéen chez les nouveaux nés traités aux antibiotiques. La dysbiose intestinale induite par antibiotique a des effets significatifs à long terme sur le développement de la cornée et l’inversion de ces effets suppressifs prend du temps.
Le développement de la vision chez les nouveau-nés est incomplet et facilement affecté par des facteurs externes, tels que le manque de nutriments, la surutilisation de médicaments et la stimulation par une lumière de haute intensité. Ces facteurs indésirables peuvent provoquer le développement anormal des globes oculaires et l’altération de la neurogenèse, altérant ainsi de manière permanente la vision. La cornée est située au niveau du segment antérieur de l’œil et est responsable de près des deux tiers de la puissance réfractive de l’axe optique. Les études récentes sur le développement de la vision se sont principalement concentrées sur la rétine, tandis que les études sur les facteurs qui affectent le développement de la cornée néonatale sont rares.
La zone cornéenne augmente progressivement après la naissance et atteint un état d’équilibre à un âge déterminé. L’angiogenèse et la neurogenèse sont des processus importants dans le développement cornéen chez les bébés. ²La surface des vaisseaux sanguins limbiques augmente progressivement après la naissance et atteint le niveau de la cornée. Les fibres nerveuses se développent d’abord dans le segment antérieur et le stroma cornéen à partir de quatre directions.
Ces fibres nerveuses épithéliales se rassemblent finalement au centre cornéen pour former le vortex typique. Il a été démontré que le microbiote intestinal aide à réguler le système immunitaire. La dysbiose induite par antibiotique du microbiote intestinal chez les nouveau-nés diminue le nombre de monocytes dans le cerveau, La carence en microbiote intestinal affecte la distribution et la maturation de la microglie et altère les réponses immunitaires innées dans le cerveau.
De plus, les bactéries filamenteuses segmentées résidentes dans le tractus intestinal sont associées à l’activation des cellules T helper 17 (Th17); une carence en ces bactéries entraîne une diminution du nombre et de la fonction des cellules Th17. Il a été démontré que les fus bactéries du tractus intestinal participent à la différenciation des cellules T régulatrices (Treg) de CD4 +Cellules T et pour induire l’expression de l’IL-10 dans les Tregs pour maintenir l’homéostasie de l’immunité. La distribution et la fonction des cellules B sont également régulées par le microbiote intestinal.
Les gens déficients en microbiote intestinal ont moins de cellules B et une capacité réduite à produire des IgA. Les macrophages, les cellules immunitaires innées, sont largement distribués dans les tissus périphériques et sont impliqués dans le développement de nombreux tissus et organes.
Par exemple, la microglie peut médier l’innervation en régulant la survie et la mort cellulaire programmée des neurones 24 et peut sécréter l’IGF-1 pour favoriser la formation de la région corticale V; une carence dans ces cellules entraîne une diminution de la complexité et de l’innervation du système nerveux central (SNC). Dans le remodelage osseux, comme dans l’éruption dentaire et l’ostéoporose, la formation osseuse est généralement altérée chez les gens présentant des macrophages défectueux. De plus, dans l’angiogenèse, les macrophages sécrètent un facteur inductible par l’hypoxie (HIF-1α), qui est impliqué dans le remodelage cardiovasculaire. Dans la neurogenèse, les macrophages sécrètent de la neurotrophine et guident la migration des cellules de Schwann pour participer à la formation des systèmes nerveux. On ignore encore si les macrophages participent au développement de la cornée, et si ces cellules sont affectées par microbiote intestinal.
Depuis le milieu du XXe siècle, les antibiotiques ont considérablement amélioré le pronostic des pathologies infectieuses. Cette grande victoire est néanmoins à l’origine de deux nouveaux défis pour les praticiens et les chercheurs : le combat contre le développement de résistances des bactéries et la lutte contre la perturbation du microbiote intestinal par les traitements antibiotiques.
Mieux comprendre l’impact des antibiotiques sur le microbiote
Au c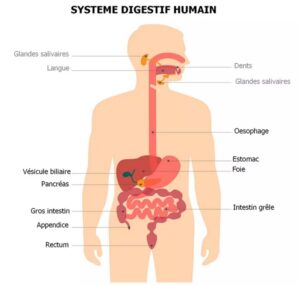 ours des dernières années, la technique de la métagénomique a permis de faire des avancées capitales dans la connaissance de l’impact des antibiotiques sur le microbiote d’un point de vue microbiologique comme de point de vue immunitaire. Tout antibiotique entraîne une rupture de l’équilibre du microbiote intestinal appelée dysbiose. Cette dysbiose est notamment caractérisée par une perte de la diversité microbienne intestinale. L’intestin contient des cellules mémoires permettant de stocker les footprints de la faune intestinale. La carence de ces informations est à l’origine d’une perturbation des fonctions dans lesquelles le microbiote joue un rôle clé.La dysbiose post-antibiotique est parfois durable. Il a été montré que le retour du microbiote intestinal à son état d’équilibre initial varie d’un individu à l’autre et nécessite dans des cas plusieurs pour être restauré.
ours des dernières années, la technique de la métagénomique a permis de faire des avancées capitales dans la connaissance de l’impact des antibiotiques sur le microbiote d’un point de vue microbiologique comme de point de vue immunitaire. Tout antibiotique entraîne une rupture de l’équilibre du microbiote intestinal appelée dysbiose. Cette dysbiose est notamment caractérisée par une perte de la diversité microbienne intestinale. L’intestin contient des cellules mémoires permettant de stocker les footprints de la faune intestinale. La carence de ces informations est à l’origine d’une perturbation des fonctions dans lesquelles le microbiote joue un rôle clé.La dysbiose post-antibiotique est parfois durable. Il a été montré que le retour du microbiote intestinal à son état d’équilibre initial varie d’un individu à l’autre et nécessite dans des cas plusieurs pour être restauré.


